|
|
 |
При заполнении таблицы для атомов с зарядами Z≥19, при переходе из одной орбитальной ячейки в другую, приходится учитывать правило Клечковского, представляющее особую сложность. Поясним его подробнее.
1. В формулировке, приведенной выше §1.1, правило удобно для составления алгоритма при программировании, например:
Sub Klechkovski()
'Для "Microsoft Word" Выдает порядок заполнения электронных орбиталей:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d.
'Основана на правиле Клечковского. Макрос создан 25.04.2008 Куклин С.А. Dim n As Integer Dim ni As Integer Dim li As Integer lstring = "spdfgh" 'буквенное обозначение оболочек Config = "" 'строка содержащая последовательность заполнения For n = 1 To 11 nx = Round((n + 1) / 2 + 0.1)
'Оболочка у которой nx+lmax=n. 0.1 добавляется для округления в большую сторону (VBasic) For ni = nx To n '
Существует еще n-nx оболочек у которых ni+li=n li = n - ni'
Орбитальное квантовое число
Config = Config + Str(ni) + Mid(lstring, li + 1, 1)
'строка содержащая последовательность заполнения Next Next Selection.Text = Config End Sub
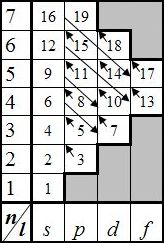
2. По сути показанный алгоритм, это математическое описание ступенчатого
подъема в горку и последующего скатывания. Визуально это выглядит следующим
образом (рисунок 4):
заполнив орбитальную ячейку, электроны начинают заполнять вышестоящую орбитальную ячейку, находящуюся левее (если она есть),
затем заполнение идет еще выше и левее и, достигнув левой границы по диагонали, переходят вниз на ещё незаполненные правые
орбитальные ячейки.
Рисунок 4 – Правило заполнения орбитальных оболочек атома,
см.также [3*,
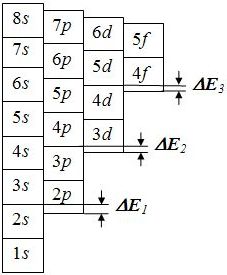
с.47] 3. С физической точки зрения уровни энергии в атоме расположены таким образом (рисунок 5),
что при росте n они постепенно сливаются – уменьшается перепад энергии
DE между верхней орбиталью и орбиталью с меньшим n
и большим l,
то есть DE3<DE2<DE1. Рисунок 5 – Уровни энергии атома 4. Еще проще: если наливать воду в сосуд, изготовленный по данной схеме, то он будет наполняться в правильном порядке:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, …. Демонстрация порядка заполнения электронами энергетических
уровней (активизируйте рисунок и щелкните по кнопке
'Show')